Das Wasser-Lexikon
Dieses Lexikon soll fortlaufend erweitert und ergänzt werden. Wenn Sie einen Begriff hinzugefügt und erläutert haben möchten, so lassen Sie es uns bitte wissen: Info@VFTV
1,2-Dichlorethan
1,2-Dichlorethan ist ein Chlorkohlenwasserstoff, der als farblose, ölige Flüssigkeit mit charakteristischem, chloroformartigem Geruch vorliegt. Industriell wird 1,2 Dichlorethan als Reinigungsmittel genutzt bzw. dient als Ausgangsprodukt für die Synthese des geringer toxischen 1,1,1-Trichlorethans. Es findet Anwendung in der Industrie als Entfettungsmitttel für Metalle, als Bestandteil von Lösemitteln und zur Fleckentfernung.
Es wirkt toxisch, ist leicht entzündlich und stark wassergefährdend, gilt als Meeresschadstoff. Im Verzeichnis für krebsgefärdende Stoffe ist 1,2-Dichlorethan in Gruppe III (gefährdend) eingeordnet.
Erhöhte Gehalte in Oberflächengewässern können auf Verunreinigungen durch undichte Leitungen oder Tanks von verarbeitender Industrie hinweisen, oder auf unsachgemäßen Umgang mit dieser Substanz. In der Wasseraufbereitung kann Dichlorethan über Belüftung oder Aktivkohlefilter weitgehend entfernt werden.
Grenzwert Trinkwasserverordnung: 0,0030 mg/L.
Acrylamid
Acrylamid, ein Monomer, ist eine syntethische Substanz (C3H5NO, Propenamid, bei Raumtemperatur ein farblos- kristallines Pulver), welche kommerziell zur Herstellung von Polyacrylamid verwendet wird. Polyacrylamid kann neben der Papierindustrie oder Kosmetikindustrie in der Trinkwasseraufbereitung als Flockungsmittel zur Anwendung kommen. Acrylamid ist auch Bestandteil des Tabackrauchs. In neueren Untersuchungen wurde Acrylamid in stärkehaltigen Lebensmitteln nachgewiesen, die durch trockenes Erhitzen behandelt wurden.
Acrylamid gilt als toxisch und wird als potenziell krebserregend eingestuft. In größeren Mengen wirkt es nervenschädigend. In der Regel gelangt Acrylamid nur bei Einsatz von Flockungsmitteln und Flockungshilfsmitteln ins Trinkwasser, diese Stoffe müssen nach den anerkannten Regeln der Technik am Ende der Aufbereitung vollständig entfernt werden.
Grenzwert Trinkwasserverordnung: 0,00010 mg/L.
Adsorption
Anlagerung von Molekülen oder Partikeln aus einer fluiden Phase an einer festen Oberfläche.
Bei der Adsorption unterscheidet man folgende Begriffe:
Adsorbens:
Feststoff, an dem auf Grund seiner physikalischen Struktur und chemischen Beschaffenheit seiner Oberfläche andere Stoffe angelagert werden. Beispiel: Aktivkohle
Adsorptiv:
Stoff in einer fluider Phase, der vom Adsorbens aufgenommen werden soll. Beispiel: organische Entfettungsmittel
Adsorbat:
Adsorbens (Aktivkohle) mit aufgenommenen Adsorptiv (Entfettungsmittel).
Aluminium
Aluminium ist ein silberweißes, dehnbares Leichtmetall, dass sich an der Luft mit einer Oxidschicht überzieht. Mit Säuren und Basen erfolgt Salzbildung, hierbei tritt es meist dreiwertig, selten einwertig auf. Mit ca 8 % in der Erdkruste ist es das häufigste Metall und dritthäufigste Element in der Erdkruste.
Gewonnen wird Aluminium aus Bauxit, Feldspate, Glimmer und Tonerden. Technisch kommt es als Legierungsbestandteil für Stähle, Bronzen, Desoxidationsmittel, als Farbanstrich, Reflektor und beim Schweißen zur Anwendung. Aluminiumverbindungen werden als Flockungsmittel und Flockungshilfsmittel in der Wasseraufbereitung eingesetzt. Auch in medizinischen Produkten und Kosmetika werden Aluminiumverbindungen verwendet.
Der Eintrag von Aluminium in Trinkwasser kann durch ungenügende Flockung, Lösungsprozesse aus Böden durch saure Niederschläge
oder Abwässer von Aluminium verarbeitender Industrie erfolgen. Im Grundwasser liegt Aluminium in Konzentrationen von 0,01 - 0,1 mg/L vor.
Wirkung auf den Menschen: Erst in höheren Dosen wirkt Aluminium schädigend.In diesem Falle kann es zu Lethargie, Blutungen im Augenbereich und zu Störungen des Kohlehydratstoffwechsels kommen. Ein Zusammenhang zwischen der Alzheimer-Krankheit und erhöhten Aluminiumkonzentrationen imTrinkwasser wird nicht ausgeschlossen. Die durchschnittliche tägliche Aufnahme über das Trinkwasser liegt bei 0,5 mg/Tag.
Grenzwert Trinkwasserverordnung: 0,200 mg/L.
Ammonium
Ammoniumverbindungen sind im Boden Produkte mikrobieller Abbauprozesse. Proteingebundener Stickstoff wird hier über Nitrit und Nitrat bis zu Ammoniak abgebaut. In lebenden Organismen entsteht im Proteinstoffwechsel Ammoniak, der in Harnstoff bzw. Harnsäure umgewandelt und ausgeschieden wird. Industriell wird Ammoniak aus Stickstoff und Wasserstoff hergestellt. Ammoniumsalze werden überwiegend als Dünger eingesetzt. Ammoniumhydrogenkarbonat ist auch unter der Bezeichnung "Hirschhornsalz" als Backhilfsmittel im Handel. Ammoniumhydroxid wurde früher in Haushalten als "Salmiakgeist" zur Reinigung benutzt.
Verunreinigungswege: Da Ammoniumverbindungen gut wasserlöslich sind, gelangen sie durch häusliche und industrielle Abwässer in die Umwelt. Desweiteren entstehen bei der Düngemittelherstellung und über Niederschläge Einträge von Ammonium ins Grundwasser.
Wirkungen auf Gewässser: Die biologische Oxidation von Ammoniumverbindungen verursacht starke Sauerstoffzehrung, fördert das Wachstum von Bakterien und Wasserpflanzen (Algen). Rohwasserseitig erhöhen verbleibende Ammonium-Gehalte die Chlorzehrung, vermindern so die Desinfektionswirkung und bewirken die Bildung von Chloraminen. Hohe Gehalte von Ammonium im Rohwasser bewirken infolge Sauerstoffmangels ein Versagen der Entmanganungsfilter.Vom Trinkwasser geht dann ein muffiger, erdiger Geschmack aus, der sensorisch abstoßend wirkt. Desweiteren sind Ammonium/Ammoniakgehalte indirekte Indikatoren für fäkale Verunreinigungen.
Grenzwert Trinkwasserverordnung: 0,50 mg/L.
Antimon
Antimon ist ein graues, silber-weiß glänzendes, sprödes Metalloid. In seinen Verbindungen tritt es analog zu Arsen drei- und fünfwertig auf.
Anionisch ist es an Metalle gebunden, kationisch liegt es als Oxid oder Sulfid vor. In der Erdkruste ist es zu 0,0001% enthalten.
Antimonverbindungen werden bei der Herstellung von Glas, Keramik, Gummi, Kunststoffen, Schädlingsbekämpfungsmitteln, Sprengmitteln und pyrotechnischen Erzeugnissen benutzt. In metallischer Form dient es als Legierungsbestandteil. Durch antimonverarbeitende Industrie gelangt es in Oberflächengewässer.
Wirksamkeit in Gewässern: In höheren Konzentrationen schädigt es Grünalgen, Kleinkrebse und Fische, da es die biologische Oxidation im Gewässer beeinträchtigt. Im Sediment und Klärschlamm erfolgt eine Anreicherung.
Wirkung auf den Menschen: Bei Inhalation erfolgt eine rasche, nahezu vollständige Resorption. Antimon wirkt in höheren Dosen toxisch, die Vergiftungssymptome ähneln Arsenvergiftungen: Erbrechen, Durchfall, Kollaps, Exsikkose, Leberschäden.
Grenzwert Trinkwasserverordnung: 0,0050 mg/L.
AOX
An Aktivkohle adsorbierbare organische Halogenverbindungen.
Arsen
Arsen ist ein graues, sprödes, glänzendes Metalloid. Wie Antimon liegt es in drei- und fünfwertiger Form vor und befindet sich in ähnlichem Anteil in der Erdkruste. Arsen ist in Spuren Bestandteil der meisten Böden. Reich an Arsenmineralien sind Buntsandsteine und Basalt. Im Grundwasser in Deutschland sind Werte bis maximal 80 µg/L As ermittelt worden, während in Mineralwasserquellen oft höhere Konzentrationen gemessen wurden.
Arsen und seine Verbindungen werden als Zusatz zu Legierungen, in der Autoindustrie, der Halbleitertechnik, Glasverarbeitung und der chemischen Industrie verwendet. Lange Zeit wurde es als Pflanzenschutzmittel im Weinbau eingesetzt. Im 1. Weltkrieg kamen Arsenverbindungen als Kampfstoffe zum Einsatz.
Arsenverbindungen gelangen durch kontaminierte Luft, Böden und über arsenhaltige Abwässer in Oberflächengewässer. Wirkung auf Gewässer: Arsen hemmt die Selbstreinigungskraft der Gewässer, tötet höhere Wasserpflanzen ab, während das Wachstum von Algen und Pilzen stimuliert wird. Molluskeln und Fische reichern organisches Arsen an. In Verbindung mit Eisen und Aluminium sedimentiert Arsen in beträchtlichem Maße.
Als starkes Gift ist Arsen(III)oxid bekannt. Es wirkt als starkes Stoffwechsel- und Kapillargift. Bei chronischen Arsenvergiftungen steht es in Verdacht, canzerogen zu wirken.
Grenzwert Trinkwasserverordnung: 0,010 mg/L.
Aufbereitungsstoffe
Während der Gewinnung, Aufbereitung und Verteilung von Trinkwasser dürfen nur Aufbereitungsstoffe verwendet werden, welche in einer Liste des Bundesministeriums für Gesundheit enthalten sind.
Diese "Liste der Aufbereitungsstoffe und Desinfektionsverfahren gemäß § 11 Trinkwasserverordnung 2001" enthält neben den Aufbereitungsstoffen noch die Verwendungszwecke, für welche der jeweilige Stoff ausschließlich eingesetzt werden darf, Reinheitsanforderungen, die zulässigen Zugabemengen, Grenzwerte nach der Aufbereitung und zu beachtende Reaktionsprodukte sowie sonstige Einsatzbedingungen.
Die Liste wird vom Umweltbundesamt geführt und im elektronischen Bundesanzeiger sowie im Internet veröffentlicht.
Benzo-(a)-pyren
Benzo-(a)-pyren gehört zur Gruppe der polyzyklischen aromatischen Kohlenwasserstoffe (PAK), hat die Form von gelblichen, nadelförmigen Kristallen und eine sehr geringe Wassserlöslichkeit. In organischen Lösungsmitteln ist Benzo-(a)-pyren gut löslich. Es entsteht durch unvollständige Verbrennungsprozesse unterschiedlicher Art, z.B. im Zigarettenrauch, in gegrillten Nahrungsmitteln, in Abgasen von Verbrennungsmotoren und Kohleöfen.
Benzo-(a)-pyrene wirken wie andere PAK nur gering toxisch, schädigen aber das Immunsystem und die Blutzellen. Desweiteren wirkt es canzerogen bei Hautkontakt oder Inhalation. Der Eintrag von Benzo-(a)-pyren in den Wasserkreislauf erfolgt durch Abrieb von Teer und Bitumen, durch Auswaschungsprozesse aus dem Boden und der Luft.
Im Grundwasser im Deutschland der 70er Jahre lagen die Konzentrationen an Benzo-(a)-pyren in einer Bandbreite von 0,1- 0,6 ng/L. Neuere Untersuchungen liegen nicht vor. Die WHO nennt in einer Studie aus dem Jahre 1998 für andere europäische Länder, Kanada und den USA Konzentrationswerte von < 0,1 bis 2 ng/L im Trinkwasser. Aus dieser Studie geht auch hervor, dass die Belastung der Allgemeinheit mit PAKs hauptsächlich über die Luft und die Nahrungsmittel erfolgt, und somit die Aufnahme über das Trinkwasser als gering einzuschätzen ist.
Grenzwert Trinkwasserverordnung: 0,000010 mg/L.
Benzol
Benzol ist ein aromatischer Kohlenwasserstoff (C6H6), der in der Natur in geringen Konzentrationen in Erdöl und Steinkohle vorkommt. Es dient als Basis für die Herstellung von Kunststoffen und Pflanzenschutzmitteln, zudem wird es als Antiklopfmittel im Benzin eingesetzt. Das Kraftfahrzeug ist somit neben benzolgewinnender und benzolverabeitender Industrie der Hauptemittent. Das in der Atmosphäre befindliche Benzol gelangt durch Niederschläge in Oberflächengewässer.
Da Benzol fettlösliche Eigenschaften hat, kann es durch die Haut, oral oder inhalativ im menschlichen Körper aufgenommen werden. Es reichert sich im Fettgewebe und im Gehirn an. Benzol wirkt auf den Menschen narkotisierend, in höheren Dosen canzerogen, mutagen und toxisch.
In der Wasseraufbereitung von Oberflächenwässern werden zur Benzolentfernung Adsorptionsverfahren (z.B. Aktivkohlefiltration) eingesetzt.
Grenzwert Trinkwasserverordnung: 0,0010 mg/L.
Blei
Blei ist ein Metall, dass meist in zweiwertiger Form, selten vierwertig auftritt. In der Erdkruste kommt es zu 0,002 % vor. An der Luft oxidiert es zu Bleioxid. Im Wasser geht es in Gegenwart von Sauerstoff in Bleihydroxid über. Größter Bleiemittent ist das Kraftfahrzeug, gefolgt von bleiverarbeiten Betrieben. Im Menschen reichert sich Blei als Summationsgift im Organismus, besonders in den Knochen an und ist für vielfältige Schädigungen bekannt. Die Ursache für erhöhte Bleigehalte in Trinkwasser sind größtenteils Bleirohre, aus denen durch chemische Wechselwirkungen mit Wasserinhaltsstoffen Blei gelöst wird.
Nach § 6 der Trinkwasserverordnung gelten für Blei zeitlich gestufte Grenzwerte:
| bis | 30. November 2013 | 0,025 mg/L |
| ab | 1. Dezember 2013 | 0,010 mg/L |
Der Grenzwert von 0,010 mg/L ist bei vorhandenen Bleirohren in der Hausinstallation praktisch nicht einzuhalten. Daher sollten Hausinstallationen aus Blei mittelfristig ausgetauscht werden. Eine Emissionsquelle für Blei können auch Werkstoffe aus Kupfer-Zink-Legierungen und Kupfer-Zinn-Zink-Legierungen sein. Je nach prozentualem Anteil der Legierungsbestandteile Blei, Arsen und Nickel kann es zu Überschreitungen der jeweiligen Grenzwerte nach der Trinkwasserverordnung kommen. Auf einen verminderten Anteil der Legierungsbestandteile in diesen Werkstoffen sollte bei Verwendung in der Hausinstallation geachtet werden.
Bor
Das Element Bor ist zu 0,001 % in der Erdkruste enthalten. In der Natur kommt es als Boroxid, in natürlichen Gewässern überwiegend in Form von Borsäure H3BO3 bzw: B(OH)3 vor. Für Pflanzen ist es ein existenzielles Element zur Stabilisierung von Menbranen. Borate werden
genutzt bei der Glasherstellung und als Flammschutzmittel, sind in Seifen, Kosmetika und Detergenzien zu finden. Über Waschmittel kann
Bor über das natürliche Vorkommen hinaus ins Trinkwasser gelangen.
Pathologisch hohe Boratbelastungen können Lethargie, Depression und Übelkeit bewirken. Die Mehrzahl dieser Wirkungen geht auf Belastungen im Arbeitsbereich zurück.
Im Trinkwasser der öffentlichen Wasserversorgungen Deutschlands werden selten mehr als 0,3 mg/L an Bor ermittelt. In anderen Ländern (USA, Großbritannien, Chile) ist geogen bedingt mit wesentlich höheren Konzentrationen an Bor zu rechnen. Auch handelsübliche natürliche Mineralwässer können deutlich mehr Bor als das Trinkwasser enthalten.
Grenzwert Trinkwasserverordnung: 1,0 mg/L.
Bromat
Brom ist ein nichtmetallisches Element der 7. Hauptgruppe im Periodensystem der Elemente. Mit anderen Elementen verbindet sich Brom zu Bromiden. Diese evtl.im Trinkwasser vorhandenen Bromide werden bei Zusatz von Ozon zu Trinkwasser in Bromate oxidiert. Die Entstehung von Bromaten während der Ozonung wird durch hohe pH-Werte bei der Aufbereitung, höhere DOC-Werte und lange Behandlungszeiten begünstigt. Bromate sind nachweislich cancerogen.
Grenzwert Trinkwasserverordnung: 0,010 mg/L.
BSB5
Biochemischer Sauerstoffbedarf in 5 Tagen.
Der BSB ist diejenige Menge an Sauerstoff, die für den oxidativen Abbau der im Wasser enthaltenen organischen Stoffe durch Mikroorganismen im aeroben Milieu innerhalb eines bestimmten Zeitraumes (5 Tage) verbraucht wird.
Der BSB wird in mg/L O2 angegeben.
Cadmium
Cadmium ist ein silberweißes, weiches Metall, bildet an der Luft eine Oxidschicht und tritt in Verbindungen meist zweiwertig auf. In der Erdrinde ist es nur zu einem geringen Anteil vertreten, es taucht als Begleitmetall in Zink-, Blei- und Kupfer-Erzen auf. Bei der Verarbeitung dieser Metalle fällt Cadmium als Beiprodukt ab. Industriell wird es als Korrosionsschutzmittel für Werkstoffe, in Cadmium-Nickel Batterien, Photozellen und Kernreaktoren verwendet. Cadmiumsalze dienen als Pigmente und Kunststoffstabilisatoren.
In die Umwelt und somit auch in das Grundwasser wird Cadmium über die Industrie, besonders die Zinkverhüttung, über Feuerungs- und Müllverbrennungsanlagen eingetragen. Zudem kann der Auftrag von cadmiumhaltigen Düngern und Klärschlämmen zu einer Belastung des Bodens beitragen. Eine Belastung mit Cadmium erfolgt auch über den Zigarettenrauch. Cadmium wirkt in hohen Dosen toxisch. Schwerwiegender, weil unbemerkter, stellt sich die kumulative Anreichung von Cadmium in Nieren und Leber dar, so dass die Nierenfunktion gestört, Knochen- und Blutbildung beeinträchtigt werden können. Durch wachsendes Umweltbewußtsein der Verbraucher ist die Cadmiumverwendung in den letzten Jahren stark rückläufig.
Im Mittel liegt die Konzentration von Cadmium in Trinkwässern in Deutschland bei 0,00006 mg/L.
Grenzwert Trinkwasserverordnung: 0,0030 mg/L.
Calcitlösekapazität
Calcit ist eine Kristallmodifikation des Calciumcarbonats (CaCO3). Als Calcitlösekapazität bezeichnet man die Masse Calcit, welche ein Wasser in einem Liter lösen kann. Sie wird rechnerisch nach DIN 38404-10 ermittelt und gibt einen Hinweis auf das korrosionschemische Verhalten eines Wassers.
Bei calcitabscheidenden Wässern wird der Wert für die Calcitlösekapazität negativ.
Grenzwert Trinkwasserverordnung: 5 mg/L.
Die Anforderung gilt als erfüllt, wenn der pH-Wert am Wasserwerksausgang mindestens 7,7 beträgt. Hinter der Stelle der Mischung von Trinkwasser aus zwei oder mehr Wasserwerken darf die Calcitlösekapazität im Verteilungsnetz den Wert von 10 mg/L nicht überschreiten.
Calcium Ca2+
Die Erdkruste besteht zu 3,6% aus Calcium (fünfthäufigstes Element). In der Natur kommt es als Kalk, Gips, Dolomit, Anhydrit, Apatit und Flußspat vor.
Ein erwachsener Mensch hat einen täglichen Calciumbedarf von etwa 800 mg. Calcium ist wichtiger Bestandteil für den Knochenbau und Fettstoffwechsel. Eine Blutgerinnung findet nur in Gegenwart von Calcium statt.
Kalkstickstoff, Calciumoxid und Kalk werden als Düngemittel eingesetzt, Kalkstickstoff wirkt gleichzeitig herbizid, d.h. unkrautvernichtend.
Bei der Trinkwasseraufbereitung werden Calciumcarbonat und Calciumhydroxid zur Entsäuerung und Aufhärtung verwendet.
Calcium ist ein wesentlicher Bestandteil der Wasserhärte. Kohlenstoffdioxidhaltige Grundwässer erfahren auf kalkhaltigem Untergrund eine Aufhärtung. Die Lösung von Calciumcarbonat hat Auswirkungen auf den pH-Wert und die Pufferkapazität des Wassers. Nach der Trinkwasserverordnung sind Calciumcarbonat-(Calcit-)gesättigte Wässer zu verteilen. Calcium ist an der Ausbildung einer schützenden Schicht im Leitungsrohr beteiligt. In übersättigten Wässern kann es vor allem im Warmwasserbereich zu Ausfällungen und damit zu Rohrverkrustungen kommen.
Chlor
Die Verbreitung von Krankheiten über das Trinkwasser hatte in der Vergangenheit teilweise verheerende Folgen und muß daher unbedingt vermieden werden. Chlor ist ein preiswertes Desinfektionsmittel, das zudem seinen Vorteil gegenüber anderen Mitteln in der Depot-Wirkung hat und somit auch noch im Rohrnetz desinfizierend wirken kann. Als ausreichende Einwirkungszeit werden 15 bis 30 Minuten angesehen. Durch die unterschiedliche Oxidationswirkung der verschiedenen Zustandsformen des Chlors nimmt die Desinfektionswirkung mit steigendem pH-Wert ab. Für die Trinkwasseraufbereitung sind Chlor, Natrium-, Calcium- und Magnesiumhypochlorit sowie Chlorkalk ausschließlich zur Desinfektion zugelassen. Nach Abschluß der Aufbereitung soll im Trinkwasser ein Restgehalt von mindestens 0,1mg/l freiem Chlor nachweisbar sein, es darf aber höchstens eine Menge von 0,3 mg/L freies Chlor enthalten. Als Reaktionsprodukte dürfen nach der Desinfektion nicht mehr als 0,050 mg/L (50 µg/L) Trihalogenmethane im Trinkwasser, am Zapfhahn des Verbrauchers, enthalten sein.
Die Bildung von unerwünschten Nebenprodukten läßt sich vermeiden, indem die Chlordosis nicht höher gewählt wird als zur Desinfektion notwendig ist und die organischen "Vorläufersubstanzen" vorher durch geeignete Aufbereitungsschritte entfernt werden.
Bei der Verwendung von Chlor sind spezielle Sicherheitsvorschriften zu beachten (abgetrennte Lagerräume, Warnanlagen usw.).
Chlorid Cl-
Chloride sind in der Natur vor allem als Natriumchlorid (Kochsalz), Kaliumchlorid und Calciumchlorid weit verbreitet. Zu etwa 0,05% kommen Chloride in der Erdkruste vor.
Der Mensch nimmt mit der üblichen Nahrung täglich zwischen 3 und 12 g Cl- (entsprechend 5 - 20 g NaCl) auf. Die Ausscheidung erfolgt über Niere und Schweiß.
Durch herkömmliche Wasseraufbereitungsverfahren lassen sich Chloridkonzentrationen nicht senken. Es bedarf hierfür Verfahren der Entsalzung (Umkehrosmose, Ionenaustausch, Destillation). Durch Zugabe von chloridhaltigen Flockungsmitteln oder Salzsäure zur pH-Wert-Korrektur wird die Chloridkonzentration im Wasser erhöht. Gehalte über 250 mg/L können dem Wasser einen salzigen Geschmack verleihen, Konzentrationen über 500 mg/L werden als unangenehm empfunden.
Grenzwert Trinkwasserverordnung: 250 mg/L
Chrom
Das Schwermetall Chrom ist ein häufiges Element und kommt in dreiwertiger und sechswertiger Form vor. Während das dreiwertige Chrom ein essentielles Spurenelement für Mensch und Tier darstellt, verursacht sechswertiges Chrom allergische Reaktionen und wird als cancerogen und mutagen angesehen. Verwendet wird Chrom in der Galvanik, als Holzimprägnierung und als Gerbstoff bei der Lederverarbeitung. Aus diesen Prozessen können chromhaltige Abwässer in Oberflächengewässer gelangen.
Im Wasser ist Chrom in beiden Wertigkeiten vertreten und teilweise an Schwebstoffe gebunden. Dabei ist unter aeroben Bedingungen sechswertiges Chrom stabil, während es unter anaeroben Bedingung zu Chrom (III) reduziert wird.
Grenzwert Trinkwasserverordnung: 0,050 mg/L.
Clostridium perfringens
Clostridium perfringens ist ein sporenbildendes Bakterium. Die Sporen sind in der Umwelt auch unter Extrembedingungen lange überlebensfähig, sie haben eine hohe Resistenz gegenüber Chlor als Desinfektionsmittel. Der Nachweis von Clostridium perfringens ist ein Indikator für das Vorhandensein von Parasiten (Cryptosporidien, Giardien), welche sich ähnlich resistent verhalten. Nach Anlage 4 der Trinkwasserverordnung ist eine Untersuchung auf Clostridium perfringens nur erforderlich, wenn das Wasser von Oberflächenwasser stammt oder von Oberflächenwasser beeinflusst wird.
Grenzwert Trinkwasserverordnung: 0/100 mL
Coliforme Bakterien
Bei der Gruppe der Coliformen handelt es sich um viele unterschiedliche Bakteriengattungen. Auch E. coli gehört dazu, ist aber als einzige Gattung eindeutig fäkalen Ursprungs. Alle weiteren Coliforme können auch in der Umwelt vorkommen und sich dort vermehren. Somit sind Coliforme nicht unbedingt ein Indikator für fäkale Verunreinigungen, können jedoch Mängel in der Aufbereitung oder bei der Wasserverteilung anzeigen. In Verteilungsnetzen können sich Coliforme bei Wassertemperaturen über 15°C und vorhandenen Nährstoffen vermehren.
Grenzwert Trinkwasserverordnung: 0/100 mL
CSB
Chemischer Sauerstoffbedarf.
Der CSB ist die Menge an Sauerstoff, die zur chemischen Oxidation der oxidierbaren Wasserinhaltsstoffe benötigt wird.
Der CSB wird ebenso wie der BSB in mg/L O2 angegeben. Da mit dem CSB auch biologisch nicht abbaubare Substanzen erfasst werden, ist der CSB-Wert einer Probe i.d.R. höher als deren BSB-Wert.
Cyanid
Cyanid ist ein einwertiges Anion. Als Salz der Blausäure kommt es in Bittermandel oder Obstkernen vor. In der Landwirtschaft findet es als Düngemittel oder Pfanzenschutzmittel Verwendung, traditionell wurde es bei der Goldgewinnung zum Auswaschen des Goldes genutzt. Cyanide sind hochgiftige Substanzen, sie hemmen die Gewebeatmung und wirken beim Menschen schon ab 1mg HCN/kg Körpergewicht letal. Cyanid ist ein starkes Fischgift.
Außer durch Abwässer von galvanischen Betrieben, Härtereien, Kokereien, Gas- und Hüttenwerken könnte Cyanid durch die Synthese bestimmter Algen und Pflanzen ins Trinkwasser gelangen. Auch die Verbrennung von Acrylaten setzt Cyanide frei. Biologische Prozesse in der Wasseraufbereitung können ab 20 µg/L CN- gehemmt werden. Eine Entfernung ist durch starke Oxidationsmittel wie z.B. Ozon möglich. Auch Chlor oxidiert Cyanide zu Cyanaten.
Grenzwert Trinkwasserverordnung: 0,050 mg/L.
Dissoziation, elektrolytische
Wasser ist das universelle und beste natürliche Lösungsmittel für viele Stoffe, z.B. Salze und Gase. Es stellt für alle biologischen Systeme das Transportmittel für diese Stoffe dar, ist also an jeder Nahrungskette und jedem Stoffwechsel maßgeblich beteiligt.
Reines Wasser H2O liegt natürlicherweise nirgendwo auf der Erde vor, denn durch den Kontakt mit Luft, Boden oder Gesteinsarten werden mehr oder weniger viele Stoffe in verschiedenen Konzentrationen aufgenommen.
Wird ein Elektrolyt -ein Salz, eine Säure oder eine Base- in Wasser gegeben, löst er sich auf und zerfällt dabei mehr oder weniger in seine Bestandteile, in Ionen (grch. "wandernde Teilchen"). Man spricht von der elektrolytischen Dissoziation.
Beispiel: Dissoziation von Natriumchlorid (Kochsalz)
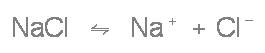
Die negativ geladenen Ionen wandern im elektrischen Feld zur positiven Anode - sie heißen deshalb Anionen -, die positiv geladenen zur negativen Kathode - man nennt sie aus diesem Grund Kationen.
Auch das Wasser selbst dissoziiert in sehr geringer Menge in H+ - Kationen und OH- - Anionen. Die Lösung ist aber weiterhin nach außen elektrisch neutral.
DOC
Dissolved organic carbon. Gelöster organisch gebundener Kohlenstoff.
Eisen Fe2+, Fe3+
Mit einem Anteil von 7% ist Eisen das vierthäufigste Element in der Erdkruste. Man nimmt an, daß der Erdkern überwiegend aus Eisen besteht. In sauerstoffarmen Grundwässern werden in Abhängigkeit von der Bodenbeschaffenheit 10 mg/L und mehr Eisen gefunden.
Für Menschen ist Eisen ein essentielles Element. Es spielt eine wichtige Rolle im Stoffwechsel und in der Atmungskette. Eisenmangelzustände sind in der Bevölkerung weit verbreitet. Der durchschnittliche tägliche Bedarf an Eisen beträgt etwa 15 mg.
In Rohwässern gelöstes (zweiwertiges) Eisen wird bei der Trinkwasseraufbereitung durch Oxidation in die (dreiwertige) unlösliche Form überführt und durch Filtration abgeschieden. Dabei sind die Filterlaufzeiten von der Eisenkonzentration im Rohwasser abhängig. Eisensalze werden in der Wasseraufbereitung als Flockungs- und Fällungsmittel eingesetzt.
Wird in Wasserleitungen aus Stahl oder Gußeisen die Schutzschichtbildung gestört, kommt es zur Korrosion. Eisen geht überwiegend als Rost in das Trinkwasser über und verleiht ihm eine rotbräunliche Färbung und Trübung. In Leitungen mit großen Stagnationszeiträumen kann bei der ersten Abnahme auch eine bräunliche Färbung auftreten. Die Leitung muß zunächst gespült werden.
Grenzwert Trinkwasserverordnung: 0,200 mg/L
Enteisenung
Als Enteisenung wird die Wasseraufbereitung zur weitgehenden Entfernung von gelöstem Eisen bezeichnet. Dabei wird das gelöste Eisen zunächst durch Oxidation (z.B. mit Luftsauerstoff) in eine schwerlösliche Form überführt und dann in einem Filter oder Absetzbecken zurückgehalten.
Die Enteisenung wird häufig in Kombination mit einer Entmanganung durchgeführt.
Enterokokken
Auch Enterokokken sind Darmbewohner von Warmblütern, welche sich im Wasser allerdings nicht vermehren. Sie sind gegenüber Umwelteinflüssen und Desinfektionsmitteln widerstandsfähiger als E. coli. Der Nachweis von Enterokokken im Trinkwasser kann somit als Indikator für eine fäkale Verunreinigung gewertet werden, die länger zurück liegt.
Grenzwert Trinkwasserverordnung: 0/100 mL
(Für Trinkwasser, das zur Abgabe in veschlossenen Behätnissen bestimmt ist, gilt der Grenzwert von 0/250 mL)
Enthärtung
Die Minderung der Gesamthärte im Wasser durch entsprechende Aufbereitungsverfahren wird als Enthärtung bezeichnet. Als Verfahren kommen die Schnell- und die Langsamentcarbonisierung, als auch der Ionenaustausch in Betracht. Neuere Untersuchungen befassen sich mit der Enthärtung durch geeignete Membranverfahren.
Die Härte eines Wassers kann auch durch Mischung herabgesetzt werden. Hierbei ist allerdings zu beachten, dass sich durch die Mischung auch das Kalk-Kohlensäure-Gleichgewicht (KKSG) verändert, und somit u. U. eine zusätzliche Aufbereitung notwendig wird.
Entmanganung
Unter Entmanganung versteht man die weitgehende Entfernung des gelösten Mangans aus einem Wasser. Ähnlich der Enteisenung wird auch hier eine Abscheidung durch Überführung der gelösten Form in eine schwerlösliche Form mittels Oxidation erreicht. Im Gegensatz zur Enteisenung wird die Oxidation durch Sauerstoff allein nicht oder nur sehr langsam durchgeführt. Die katalytisch wirkenden Oberflächen von eingearbeiteten oder spezifischen Filtermaterialien sowie die Mithilfe von manganoxidierenden Bakterien sind hier notwendig.
Entsäuerung
Die Anhebung des pH-Wertes durch geeignete Aufbereitungsverfahren wird als Entsäuerung bezeichnet. Hier stehen physikalische (Belüftung zum Austrag von gelöstem Kohlenstoffdioxid) und chemische (Dosierung von alkalisch reagierenden Stoffen bzw. Filtration über alkalisch reagierende Materialien) Verfahren zur Verfügung.
Epichlorhydrin
Epichlorhydrin ist eine eine farblose Flüssigkeit, die als Monomer zur Herstellung von Epoxidharzen dient. Gut lösbar in organischen Substanzen, aber schwerlöslich in Wasser. Die Synthese erfolgt über die Addition von Hypochlorsäure an Allylchlorid. Außer in der Verwendung zur Epoxidharzherstellung wird es zur Herstellung von Desinfektionsmitteln und Insektiziden eingesetzt.
Epichlorhydrin hat schädigende Wirkung auf Nieren und Nervensystem und wirkt stark canzerogen. Es reizt Atemwege, Schleimhäute und Augen. Durch Epoxidharzauskleidungen von Rohren und Behältern könnten Monomere ins Trinkwasser gelangen., bei Vorhandensein dieser Auskleidungen soll ein Epichlorhydrinwert auf Basis von Produktinformationen und -spezifikationen in Leitlinien berechnet werden.
Grenzwert Trinkwasserverordnung: 0,00010 mg/L.
Der Grenzwert bezieht sich auf die Restmonomerkonzentration im Trinkwasser, berechnet auf Grund der maximalen Freisetzung nach den Spezifikationen des entsprechenden Polymers und der angewandten Polymerdosis. Der Nachweis der Einhaltung des Grenzwertes kann auch durch die Analyse des Trinkwassers erbracht werden
Escherichia coli (E.coli)
Escherichia coli (E. coli) sind Darmbewohner von Warmblütern und bis auf wenige Spezies für den Menschen ungefährlich. Das Vorhandensein von E. coli wird als Indiz für fäkale Verunreinigung des Wassers gewertet, was die Möglichkeit der Existenz von Krankheitserregern einschließt.
Grenzwert Trinkwasserverordnung: 0/100 mL
(Für Trinkwasser, das zur Abgabe in veschlossenen Behätnissen bestimmt ist, gilt der Grenzwert von 0/250 mL)
Fällung
Ausscheidung schwer löslicher Verbindungen aus Lösungen.
Färbung
Die EG-Richtlinie 98/93 über die Qualität von Wasser für den menschlichen Gebrauch formuliert allgemein: Die Färbung soll für den Verbraucher annehmbar und ohne anormale Veränderung sein. Die Trinkwasserverordnung stellt die Anforderung, dass Wasser frei von Krankheitserregern, genusstauglich und rein sein soll. Auch nach der DIN 2000 soll Trinkwasser farblos sein. Höhere Gehalte an organischen Substanzen wie z.B. Huminstoffe färben das Wasser gelb bis braun. Auch Einbrüche von Fäkalien in Rohwasser können Färbungen bewirken. In reduzierten Grundwässern treten erhöhte Eisen- und Mangangehalte auf, ein nachfolgender Sauerstoffzutritt erzeugt gelbbraune F&aulm;rbungen.
Neben diesen visuellen Wahrnehmungen kann die Färbung aber auch über den spektralen Absorbtionskoeffizienten (SAK) im Spektralfotometer gemessen werden. Hierbei wird die Schwächung des durchfallenden Lichts der Wellenlänge 436 nm (Nanometer) bestimmt und auf eine Wasserschichtdicke von 1m bezogen.
Grenzwert Trinkwasserverordnung: 0,5 m-1. Hier kann praktisch von einer Farblosigkeit des Wassers ausgegangen werden.
Flockung
Erzeugung sichtbarer und abtrennbarer Flocken.
Fluorid
Fluorid ist das einwertige Anion (F-) des Fluorwasserstoffs. Es kommt in Form von Verbindungen vor, die überwiegend in Gesteinen zu finden sind. Die Häufigkeit in der Erdkruste wird mit 0,065 Gew.% angegeben. Über fluoridhaltiges Gestein gelangt dieser Salzanteil in das Trinkwasser. In Deutschland finden sich in Abhängigkeit vom Grundwasserleiter Mittelwerte von 0,1 mg/L und 0,18 mg/L. Nur in 0,3 % aller Trinkwasserproben lagen die Fluoridgehalte bis 1,5 mg/L. Geogen und/oder umweltbedingt sind in Ländern wie Indien, Kenia, Südafrika Fluoridkonzentrationen von über 25 mg/L eruiert worden.
Fluorid wird leicht vom Organismus aufgenommen und wieder abgeschieden, es befindet sich zu 98 % in den Knochen und Zähnen. Fluoridmengen um 1 mg/L wirken kariesprophylaktisch, hingegen können schon Mengen von 1,5 bis 2 mg/L täglich zur Dentalfluorose führen. Diese bewirkt eine Schädigung des Zahnschmelzes und führt zur Osteosklerose, einer Krankheit, die Starrheit der Wirbelsäule, Thorax und Gelenke bewirken kann.
Bedingt durch das enge Nebeneinader von schützender und schädigender Wirkung von Fluorid ist die Fluoridierung des Trinkwasssers in Deutschland nicht angedacht. Abgesehen von der möglichen Unterlassung von individueller Zahnhygiene des Verbrauchers würde eine Fluoridierung von Trinkwasser zu einer erheblichen Belastung der Umwelt mit Fluorid führen, nicht anders zu bewerten als eine industrielle Emission dieses Stoffes. Desweiteren wird eine Fluoridirung über Trinkwasser kontrovers als "Zwangsmedikamentation" diskutiert
Grenzwert Trinkwasserverordnung: 1,5 mg/L
Geruch
Zur Prüfung eines Trinkwasssers auf Geruch stehen folgende Möglichkeiten zur Verfügung: Olfaktometrie, chemische Einzelstoffanalytik und Sensortechniken. Hierbei ist die Olfaktometrie die empfindlichste und universellste Analysenmethodik. Die Wasserprobe wird hierbei mit geruchs- oder geschmacksfreiem Wasser so stark verdünnt, bis kein Geruch bzw. Geschmack mehr feststellbar ist . Dieser Wert wird als 1 definiert. Die Resultate zeigen starke Abhängigkeit von Prüfräumen und der Leistungsfähigkeit des Prüfpersonals.
In der Trinkwasserverordnung sind für den Geruch Grenzwerte festgelegt, die auf dieser subjektiven Beurteilung (Geruchsschwellenwert TON) beruhen.
Grenzwert Trinkwasserverordnung: 3 TON bei 23 °C.
Bei der routinemäßigen Untersuchung kann alternativ eine qualitative Untersuchung durchgeführt werden, mit dem Ziel, einen für den Verbraucher annehmbaren Geruch zu attestieren und anormale Veränderungen auszuschließen.
Gesamthärte
Als Gesamthärte wird die Summe der Stoffmengenkonzentrationen der Erdalkali-Ionen im Wasser bezeichnet.
Als wesentliche Bestandteile vieler Wässer sind hier die Calcium- und Magnesium-Ionen von Bedeutung. Die übrigen Ionen der Erdalkaligruppe liegen im allgemeinen in nur unbedeutender Konzentration im Wasser vor.
Nach § 9 des Wasch- und Reinigungsmittelgesetzes (WRMG) sind Wasserversorgungsuntenehmen verpflichtet, den Verbrauchern den Härtebereich des vom Wasserversorgungsunternehmen abgegebenen Trinkwassers mindestens einmal jährlich auf geeignete Art bekanntzugeben.
Gesamtrichtdosis
Gesamtrichtdosis bezeichnet einen summarischen Parameter, der alle künstlichen und natürlichen Radionuklide berücksichtigt, mit Ausnahme von Tritium , Kalium-40 sowie Radon und dessen Zerfallsprodukte.
Der summarische Parameter Gesamtrichtdosis bezeichnet eine Rechengröße aus dem Produkt der Radioaktivitätskonzentration, einem für jedes Radionuklid festgelegten Dosisfaktor und dem Trinkwasserkonsum.
Die Radioaktivitätskonzentrationen der einzelnen Radionuklide werden in Becquerel pro Liter Trinkwasser angegeben (Bq/L); der Dosiskoeffizient gibt diejenige Dosis in der Einheit Sievert an, die aus der Zufuhr der Aktivität von 1 Becquerel eines Radionuklids resultiert (Sv/Bq); der jährliche Trinkwasserkonsum wird in Liter pro Jahr bestimmt (L/a).
Aus einer Vielzahl von natürlichen und künstlichen Radionukliden könnten, im Hinblick auf die Trinkwasserversorgung, die Konzentrationen der natürlichen Radionuklide Ra-226, Ra-228, U-238, U-235, U-234, Th-232, Th-234 von Bedeutung sein, wie neuere Untersuchungen (2003) zeigen.
Die Bestimmung der Gesamtrichtdosis stellt somit ein aufwendiges Verfahren dar. Verbindliche Vorschriften und konkrete Vorgaben, wie die gesetzlich vorgegeben Parameter Tritium und Gesamtrichtdosis auf ihre Einhaltung zu überprüfen sind, gibt es derzeit nicht. Entsprechende Entwürfe sind in der Bearbeitung.
Im Trinkwasser ist laut Anlage 3 der Trinkwasserverordnung der Indikatorparameter Gesamtrichtdosis mit einem Grenzwert von 0,1 mSv/Jahr einzuhalten.
Geschmack
Die Geschmackswahrnehmung beruht auf der selektiven Reaktion der Sinneszellen mit anorganischen u. organischen Stoffen. Geschmacksstoffe imTrinkwasser werden erst dann bewußt wahrgenommen, wenn sie eine gewisse Schwellenkonzentration überschreiten und somit als auffällig empfunden werden. Die in der Trinkwasserverordnung definierte Größe für Geschmack "für den Verbraucher annehmbar und ohne anormale Veränderung" ist sehr weit gefaßt und schwer in Prüfkriterien einzubinden.
Grenzwert Trinkwasserverordnung: für den Verbraucher annehmbar und und ohne anormale Veränderung.
HACCP
Hazard Analysis Critical Control Points
Das aus der Lebensmittelhygiene stammende Prinzip kann zur Sicherstellung der Trinkwasserqualität eingesetzt werden. Es besteht aus drei Schritten:
1. Gefahrenanalyse und -Bewertung
2. Identifikation von Kontrollpunkten für als wesentlich bewertete Gefahren zur Minimierung des Risikos.
3. Sicherstellung, daß die Kontrolle wirksam ausgeführt wird.
Härtebereich
Nach § 9 des Wasch- und Reinigungsmittelgesetzes (WMRG) werden Wässer unterschiedlicher Gesamthärte in 3 Härtebereiche eingeteilt:
| Härtebereich |
Stoffmengenkonzentration
mmol/L |
deutsche Härtegrade
(veraltet)
°dH |
| weich |
c(E) < 1,5 |
GH° < 8,4 |
| mittel |
1,5 <= c(E) <= 2,5 |
8,4 <= GH° <= 14 |
| hart |
2,5 < c(E) |
14 < GH° |
Ionenaustauscher
Ionenaustauscher sind unlösliche, hochmolekulare Stoffe, die in der Lage sind, bewegliche Ionen aus der eigenen Matrix gegen Ionen aus dem umgebenen Medium auszutauschen.
In der Wasseraufbereitung kommen synthetische organische Austauscherharze zum Einsatz für die:
- Vollentsalzung (z.B. Kesselspeisewasser)
- Enthärtung (z.B. Trinkwasser, Lebensmittelindustrie)
- Entfernug von Nitrat und Sulfat
- Entfernung oder Rückgewinnung von Metallen
- Entfernung von organischen Substanzen (z.B. Huminstoffe) durch makroporöse Adsorberharze.
Die Ionenaustauscher sind selektiv, d.h. sie tauschen bestimmte Ionen bevorzugt aus.
Kalium K+
Als siebthäufigstes Element ist Kalium mit 2,6% in der Erdkruste vertreten. In Grundwässern sind K+ -Ionen meist in viel geringeren Mengen enthalten als Na+ -Ionen, da Kalium ein bedeutender Pflanzennährstoff ist.
Der menschliche Bedarf an Kalium beträgt etwa 2 - 3 g pro Tag.
Wirkungen auf die Wasseraufbereitung und auf das Rohrnetz sind bei Kalium nicht bekannt.
Kalk-Kohlensäure- Gleichgewicht (KKSG)
Mit dem Begriff "Kalk-Kohlensäure-Gleichgewicht" (KKSG) wird das chemische Gleichgewicht in wässriger Lösung zwischen den Ionen der Kohlensäure
(Hydrogencarbonat, HCO3- und Carbonat, CO32-), dem Kohlenstoffdioxid (CO2) und dem Calciumcarbonat (CaCO3)
beschrieben. Dieses Gleichgewicht bestimmt wesentlich den kalkabscheidenden oder kalklösenden Charakter eines Wassers.
Praktisch findet das KKSG in der Analysenkontrolle, bei korrosionschemischen Beurteilungen, bei Mischungsrechnungen und bei der Planung / Auslegung von Aufbereitungsanlagen zur Entsäuerung Anwendung.
Die exakte mathematische Beschreibung des KKSG ist aufgrund der zwei Dissoziationsstufen der Kohlensäure und zahlreicher Komplexierungsreaktionen sehr umfangreich.
Karbonathärte
Die Karbonathärte ist der Anteil der Gesamthärte (berechnet aus den Calcium- und Magnesiumgehalten), welcher als Hydrogencarbonat HCO3- vorliegt. Sie kann aus der Säurekapazität eines Wassers errechnet werden, wird in °dH angegeben.
Karbonathärte und Säurekapazität geben das Pufferungsvermögen eines Wassers wieder.
Koloniezahl (22°C / 20°C)
Die Koloniezahl bei 22°C bedeutet eine quantitative Bestimmung von kultivierbaren Mikroorganismen in einer definierten Menge Trinkwasser (1 mL) bei 22°C auf einem nährstoffarmen Nährmedium. Bei diesem Verfahren wird bei einer Bebrütungszeit von 72 Stunden und einer Auszählung ohne Zuhilfenahme einer Lupe gearbeitet.
Die Anwendung des Verfahrens nach Anlage 5 Teil I der Trinkwasserverordnung ist ebenfalls zulässig. Da es gut eingeführt ist, wird es in der Praxis meist favorisiert. Hierbei wird das zu untersuchende Wasser (1 mL) im Plattengussverfahren mit nährstoffreichem Agar versetzt und bei 20°C für 44 Stunden inkubiert. Gewachsene Kolonien, die bei einer 6- 8fachen Lupenvergrößerung sichtbar sind, werden ausgezählt.
Die Angabe des Ergebnisses erfolgt als Kolonie bildende Einheiten (KBE) / mL.
Grenzwerte Trinkwasserverordnung:
Koloniezahl bei 22°C: ohne anormale Veränderung.
(Für Trinkwasser, das zur Abgabe in veschlossenen Behätnissen bestimmt ist, gilt der Grenzwert von 100/mL)
Koloniezahl bei 20°C: 100/mL am Zapfhahn des Verbrauchers bzw. 20/mL unmittelbar nach Abschluss der Aufbereitung im desinfizierten Wasser
Koloniezahl (36°C)
Die Koloniezahl bei 36°C bedeutet eine quantitative Bestimmung von kultivierbaren Mikroorganismen in einer definierten Menge Trinkwasser (1 mL) bei 36°C auf einem nährstoffarmen Nährmedium. Bei diesem Verfahren wird bei einer Bebrütungszeit von 72 Stunden und einer Auszählung ohne Zuhilfenahme einer Lupe gearbeitet.
Die Anwendung des Verfahrens nach Anlage 5 Teil I der Trinkwasserverordnung ist ebenfalls zulässig. Da es gut eingeführt ist, wird es in der Praxis meist favorisiert. Hierbei wird das zu untersuchende Wasser (1 mL) im Plattengussverfahren mit nährstoffreichem Agar versetzt und bei 36°C für 44 Stunden inkubiert. Gewachsene Kolonien, die bei einer 6- 8fachen Lupenvergrößerung sichtbar sind, werden ausgezählt.
Die Angabe des Ergebnisses erfolgt als Kolonie bildende Einheiten (KBE) / mL.
Grenzwerte Trinkwasserverordnung:
Koloniezahl bei 36°C: ohne anormale Veränderung.
(Für Trinkwasser, das zur Abgabe in veschlossenen Behätnissen bestimmt ist, gilt der Grenzwert von 20/mL)
Koloniezahl bei 36°C: 100/mL (Verfahren mit nährstoffreichem Agar)
Kupfer
Kupfer ist mit 0,0007% an der Erdkruste beteiligt. Der Werkstoff Kupfer wird bei der Produktion von z.B. Kabeln, Rohrleitungen und Behältern eingesetzt. In Gewässern wirkt Kupfersulfat in Konzentrationen ab 0,1 mg/L algizid. Erhöhte Kupferkonzentrationen bewirken grünliche Abscheidungen an Armaturen und Installationen (z.B. Wasch- oder Toilettenbecken).
Grenzwert Trinkwasserverordnung: 2,0 mg/L
Zur Eignung von Kupferrohren für die Trinkwasserinstallation möchten wir hier auf die DIN 50930-6 verweisen.
Legionellen
Legionellen sind Bakterien mit beträchtlicher Chlor-Resistenz. Sie vermehren sich gut in Warmwassersystemen und Luftwäschern von Klimaanlagen (Wachstumsoptimum bei 32°C - 42°C; bei Temperaturen > 60°C erfolgt rasches Absterben). Bei Übertragung durch Aerosole in die Atmungswege ist die Erkrankung an Legionellose möglich.
Nach § 14 (3) und Anlage 4 der Trinkwasserverordnung muss in Trinkwasser-Installationen mit Großanlage(n) zur Trinkwassererwärmung mindestens einmal jährlich auf Legionellen, an mehreren repräsentativen Probenahmestellen gemäß den allgemein anerkannten Regeln der Technik, untersucht werden.
Technischer Maßnahmenwert Trinkwasserverordnung: 100/100 mL
Leitfähigkeit, elektrische
Die elektrische Leitfähigkeit von Wässern beruht auf deren Gehalt an ionogen gelösten Stoffen. Sie ist Abhängig von der Konzentration, der elektrochemischen Wertigkeit, der
Ionenbeweglichkeit und dem Dissoziationsgrad der gelösten Elektrolyte.
Die Leitfähigkeit gilt als Maß für die Ionenkonzentration der im Wasser gelösten Stoffe, gibt allerdings keinen Aufschluss über die einzelnen Spezieskonzentrationen. Die Messwerte werden auf eine Bezugstemperatur umgerechnet angegeben.
Grenzwert Trinkwasserverordnung: 2790 µS/cm bei 25°C
Magnesium Mg2+
Magnesium ist mit 2,1% an der Erdkruste beteiligt (achthäufigstes Element). Magnesium ist essentieller Pflanzennährstoff und somit auch in vielen Düngemitteln enthalten. Das basische Magnesiumcarbonat dient als Pudergrundlage und Füllstoff.
Nach Calcium ist Magnesium wesentlichster Bestandteil der Wasserhärte. Bei der Entsäuerung von Trink- und Brauchwasser mit Magnesiumverbindungen erfolgt eine Aufhärtung des Wassers. Der Gleichgewichts-pH-Wert eines Wassers kann bei der Aufbereitung mit magnesiumhaltigen Filtermaterialien überschritten werden, ein kalkabscheidendes Wasser entstehen.
Der tägliche Magnesiumbedarf eines Erwachsenen beträgt etwa 325 mg. Magnesium ist im Körper in den Knochen, Skelettmuskeln, im Nervensystem und in der Leber zu finden.
Mangan Mn2+, Mn4+
Mangan ist Bestandteil einer Vielzahl von Erzen und kommt in Der Erdkruste zu 0,18% vor. Es tritt häufig in eisenhaltigen Grundwässern auf; allerdings in geringeren Konzentrationen als das Eisen.
Beim Menschen ist Mangan z.B. an der Regulierung des Kohlenhydrat- und Cholesterinstoffwechsels beteiligt und spielt eine Rolle bei der Entwichklung des Skeletts. Die Empfohlene Aufnahmemenge beträgt etwa 2 - 3 mg Mn pro Tag (Nahrungsaufnahme, Schwarzer Tee).
Bei der Wasseraufbereitung wird Mangan ebenso wie Eisen durch Oxidation und anschließender Filtration weitgehend entfernt. Manganabscheidende Mikroorganismen unterstützen die Vorgänge im Filter. Nicht ausreichend entferntes Mangan kann im Trinkwasser zu braun-schwarzen Trübungen führen. Kaliumpermanganat ist ein nach Trinkwasserverordnung zugelassener Stoff zur Oxidation und Desinfektion von Rohrleitungen.
Geringe Mengen an Mangan führen über lange Zeiträume zu Ablagerungen im Rohrnetz. Bei Rohrnetzspülungen oder Betriebsumstellungen (andere Strömungsverhältnisse, Fließrichtungsumkehr, Umstellung auf Fernversorgung durch ein unterschiedliches Wasser) können diese Ablagerungen aufgewirbelt werden und zu den schon oben genannten Trübungen führen. Zudem besteht die Gefahr der Wiederverkeimung bei Ablagerung von organischen Stoffen mit dem Mangan ("Nährboden").
Grenzwert Trinkwasserverordnung: 0,050 mg/L Mn
Natrium Na+
Die Erdkruste besteht zu 2,6% aus Natrium (sechsthäufigstes Element). Meerwasser enthält ca. 10,5 g/L Na. Die Empfohlene Menge für die tägliche Zufuhr von Natrium liegt bei 2 - 3 g (Mindestbedarf), die durchschnittlich mit der Nahrung aufgenommene Menge zwischen 5 und 20 g pro Tag.
Natrium ist das Gegenion zu Calcium- und Magnesium- bei der Enthärtung über Ionenaustausch. Wirkungen auf die Wasseraufbereitung und auf das Rohrnetz sind bei Natrium nicht bekannt.
Grenzwert Trinkwasserverordnung: 200 mg/L
Nickel
Nickel ist ein meist zweiwertig auftretendes, silberweißes, zähes, dehnbares Metall und zu 0,008 % in der Erdkruste vorhanden. Als Legierungsbestandteil verbessert Nickel die Materialeigenschaften von Edelstählen, Kupferwerkstoffen, etc., es wird als Katalysatorbestandteil, als Pigment in Keramiken, Kunststoffen, Emailllen und Farben verwendet. Bei der Galvanisation kommmt es in großem Umfang zum Einsatz.
98 % aller Nickelemissionen werden durch Großfeuerungsanlagen in die Atmosphäre eingetragen und gelangen durch Niederschläge in den Wassserkreislauf. Außer durch Abwässer von nickelverabeitenden Betrieben erhöhen nickelhaltige Installationen die Konzentrationen von Nickel im Trinkwasser.
Nickel ist wahrscheinlich ein Spurenelement, höhere Konzentrationen können zu akuten Vergiftungen mit Übelkeit, Erbrechen, Durchfall, Kopfschmerzen führen. Nickel ist das häufigste Kontaktallergen, auch atemallergene Wirkungen wurden beobachtet. Die Aufnahme von Nickel erfolgt über Nahrungsmittel und Trinkwasser. Es besteht eine Korrelation zwischen der Aufnahme von Nickel über Nahrung und Trinkwasser und dem Verlauf des allergenen Krankheitsgeschehens.
Grenzwert Trinkwasserverordnung: 0,020 mg/L.
Nitrat NO3-
Nitrat kommt im Boden als Produkt biologischer Prozesse vor. Pflanzen nehmen Stickstoff in Form von Nitrat oder Ammonium als Nährstoff auf und entziehen ihn so dem Boden. Bei landwirtschaftlich genutzten Böden wird dieser Stickstoffverlust durch Düngung kompensiert. Nitrat kann in Form von Mineraldünger oder organischem Dünger (Gülle, Mist usw.) aufgebracht werden. Durch intensive Landwirtschaft verdreifachte sich in der Bundesrepublik der Verbrauch von Kunstdünger innerhalb von 20 Jahren.
Während Stickstoff früher ein Mangelelement im Boden darstellte, liegt heute infolge von Überdüngung eher ein Überangebot in Form von Nitrat vor, was in Grundwässern zu zunehmenden Problemen führt. Stickstoffdüngung außerhalb der Vegetationsperiode kann zum sprunghaften Anstieg der Nitratkonzentration im Grundwasser führen.
Die durchschnittliche Aufnahme von Nitrat über Nahrungsmittel beträgt etwa 75 mg pro Person und Tag. Die Toxizität von Nitrat selbst ist relativ gering. Säuglinge können bei erhöhter Nitrataufnahme durch die Nahrung gefährdet sein, weil dadurch der Sauerstofftransport im Blut gestört werden kann. Dieses Krankheitsbild ist bei eingehaltenem Grenzwert nach Trinkwasserverordnung für Trinkwasser praktisch bedeutungslos.
Die eigentliche Gefahr von Nitrat liegt bei einer möglichen Reduktion zu Nitrit, im Organismus oder in nitrathaltigen Lebensmitteln bei längerer Lagerung.
Mögliche Wasseraufbereitungsverfahren zur Nitrateliminierung sind der Ionenaustausch oder die Umkehrosmose. Beide Verfahren wirken jedoch nicht selektiv, d.h. auch andere, u.U. wichtige Wasserinhaltsstoffe werden entfernt oder ausgetauscht. Die biologische Nitratentfernung wird in der Abwassertechnik häufig eingesetzt.
Grenzwert Trinkwasserverordnung: 50mg/L
Nitrit NO2-
Nitrit ist Bestandteil des Stickstoffkreislaufs im Boden und kommt als Zwischenprodukt bei der Oxidation zu Nitrat oder Reduktion von Nitrat vor. Die Umsetzung erfolgt meist in wenigen Stunden. Nitrithaltiges Pökelsalz wird in der Lebensmittelindustrie verwendet.
Durchschnittlich nimmt jeder Erwachsene 3,3 mg/Tag Nitrit auf, davon etwa 50% aus Fleischerzeugnissen.
Mit in Lebensmitteln vorkommenden Aminen können aus Nitrit canzerogene Nitrosamine entstehen.
Grenzwert Trinkwasserverordnung: 0,50 mg/L (0,10 mg/L am Wasserwerksausgang)
Oxidierbarkeit
Die Oxidierbarkeit von Trinkwasser weist auf das Vorhandensein von organischen Wasserinhaltsstoffen hin. Da die gezielte Einzelstoffanalytik bei der Vielzahl von organischen Verbindungen nur sinnvoll ist, wenn Grenzwerte der Trinkwasserverordnung ermittelt werden (z.B. bei Pflanzenschutzmitteln, Trihalogenmethanen etc.), stellt dieser Summenparameter eine Indikatorfunktion für die organisch-chemische Belastung von Wässern dar. Realisiert wird die Bestimmung über die Oxidation von organischen Wasserinhaltsstoffen mit Permanganat oder bei der TOC-Bestimmung. Bei Anwendung des Verfahrens Permangantindex werden besonders Huminstoffe, Phenole und Kohlehydrate im Trinkwassser oxidiert, so dass dieser Summenparameter bei der allgemeinen Kontrolle der Trinkwasseraufbereitung (Flockung, Filtration) angewendet wird.
Der Parameter Oxidierbarkeit braucht nach Trinkwasserverordnung nicht bestimmt zu werden, wenn der Parameter TOC bestimmt wird.
Grenzwert Trinkwasserverordnung: 5,0 mg/L O2.
PAK
Polycyclische Aromatische Kohlenwasserstoffe
(engl. Polynuclear Aromatic Hydrocarbons, PAH)
PAK sind Produkte der unvollständigen Verbrennung von organischem Material. Sie sind somit nicht nur in Abgasen zu finden, sondern auch in gegrillten und geräucherten Lebensmitteln.
Nach Trinkwasserverordnung werden folgende 4 Substanzen erfaßt, für die ein summarischer Grenzwert gilt:
Benzo-(b)-fluoranthen, Benzo-(k)-fluoranthen, Benzo-(ghi)-perylen, Indeno-(1,2,3-cd)-pyren.
Grenzwert Trinkwasserverordnung: 0,00010 mg/L.
Für Benzo-(a)-pyren gilt nach Trinkwasserverordnung ein separater Grenzwert von 0,000010 mg/L.
Pflanzenschutzmittel und Biozidprodukte
Pflanzenschutzmittel-Wirkstoffe und Biozidprodukt-Wirkstoffe stehen hier als Oberbegriff für organische Herbizide, organische Insektizide, organische Fungizide, organische Nematizide, organische Akarizide, organische Rodentizide, organische Algizide, organische Schleimbekämpfungsmittel, verwandte Produkte sowie relevante Metabolite, Abbau- und Reaktionsprodukte. Die Überwachung der einzelnen Produkte richtet sich danach, ob das Vorhandensein im betreffenden Wassereinzugsgebiet wahrscheinlich ist.
Kein anderes Lebensmittel als Trinkwasser wird täglich in Mengen von 1-2 Litern pro Person aufgenommen. Daher kommt der Grenzwertsetzung im Bereich Pflanzenschutzmittel und Biozidprodukte die Bedeutung eines Schutzwalles zu und besitzt Vorsorgecharakter. Sie fußen auf den Trinkwasserleitlinien der WHO. Diese Leitlinien beinhalten auch detaillierte Empfehlungen zum Resourcenschutz und korrelieren mit den der DIN 2000 für Planung, Bau und Betrieb von zentralen Anlagen zur Versorgung mit Trinkwasser. Hier wird das Prinzip der Vermeidbarkeit von toxikologischen Stoffen dem der toxikologischen Verträglichkeit vorgeschaltet.
Grenzwerte Trinkwasserverordnung:
0,00010 mg/L (gilt jeweils für die einzelnen Pflanzenschutzmittel- und Biozidprodukt-Wirkstoffe).
0,000030 mg/L (gilt für Aldrin, Dieldrin, Heptachlor und Heptachlorepoxid).
0,00050 mg/L (gilt für Pflanzenschutzmittel- und Biozidprodukt-Wirkstoffe insgesamt: die Summe der bei den Kontrollverfahren nachgewiesenen einzelnen Pflanzenschutzmittel- und Biozidprodukt-Wirkstoffe.
pHC-Wert
Der pH-Wert der Calcitsättigung. Dieser pH-Wert stellt sich ein, wenn ein Wasser eine ausreichend lange Zeit mit Calciumcarbonat in der Modifikation Calcit in Kontakt gebracht wird.
Der pHC-Wert kann sowohl experimentell als auch rechnerisch ermittelt werden.
pH-Wert
Der pH-Wert ist der negative dekadische Logarithmus der auf die Standardaktivität bezogenen Wasserstoff-Ionen-Aktivität a(H+).
Anmerkung: Näherungsweise wird statt der Wasserstoff-Ionen-Aktivität häufig die Wasserstoff-Ionen-Konzentration c(H+) eingesetzt. Dies führt
allerdings schon bei geringsten Ionenstärken zu deutlichen Fehlern.
Für den Ablauf vieler wasserchemischer Prozesse ist der pH-Wert von entscheidender Bedeutung. In der Wasseraufbereitung sind verschiedene Verfahren (z.B. Entsäuerung, Enteisenung, Flockung, Desinfektion) in Abhängigkeit vom pH-Wert auszulegen und zu betreiben. Korrosionschemische Beurteilungen von Wässern benötigen den pH-Wert als Grundlage.
Die Trinkwasserverordnung verlangt, dass ein Trinkwasser einen pH-Wert von mindestens 6,5 und höchstens 9,5 aufzuweisen hat. Zudem sollte das Wasser nicht korrosiv wirken (die Beurteilung hierfür erfolgt nach den allgemein anerkannten Regeln der Technik, z.B. DIN 50930). Zudem sind die Anforderungen für den pH-Wert noch an die Anforderungen für die Calcitlösekapazität geknüpft.
Pseudomonas aeruginosa
Pseudomonas aeruginosa ist ein ubiquitärer, feuchtigkeitsliebender Krankheitserreger. Er kommt im Darmkanal und in der Hautflora von Mensch und Tier vor. Der sehr widerstandsfähige Keim kann sich in den Biofilmen von Wasserversorgungssystemen vermehren und hat eine besondere Bedeutung im Bereich von Krankenhäusern und Schwimmbädern. Bei Kleinkindern kann der Keim Magen-Darm-Erkrankungen verursachen, bei geschwächten Organismen oder (bei unzureichender Desinfektion) im Schwimmbadbereich kann er Infektionen von Haut und Ohr hervorrufen.
Grenzwert Trinkwasserverordnung: 0/250 mL
(Gilt für Trinkwasser, das zur Abgabe in veschlossenen Behätnissen bestimmt ist.)
Quecksilber
Quecksilber ist ein flüssiges, silberweißes, stark glänzendes Metall. Metallisches Quecksilber tritt nur selten in der Erdkruste auf, aber es existieren mindestens 65 anorganische und organische Verbindungen, meist Salze oder Alkyl-Verbindungen. Hier tritt es ein- bis zweiwertig auf.
Genutzt wird es als Legierungsbestandteil bei Metallen (Amalgam). Der Einsatzereich von Quecksilber liegt in der Messtechnik, der elektronischen Industrie und in der chemischen Industrie, z.B. als Kathodenmaterial. Organische Quecksilberverbindungen werden Anstrichfarben wegen ihrer fungiziden Wirkung zugesetzt. Kontaminationsquellen sind Müllverbrennungsanlagen, Verbrennung fossiler Brennstoffe und Abwässer erz- und quecksilberverarbeitender Betriebe.
Wirkung auf Menschen: Bei Inhalation, Aufbringung auf die Haut oder oraler Aufnahme kommt es zur Quecksilbervergiftung, die sich besonders in Nierenschädigungen und Beeinträchtigung des zentralen Nervensystems zeigt.
Wirkung in Gewässern: Es erfolgt eine Enzyminhibitation und somit Beeinträchtigung der Stoffwechseltätigkeit bei Mikroorganismen, ab 18 µg/l wird die Selbstreinigungskraft von Gewässern gestört. Bei höheren Konzentrationen wird die Chlorophyllbildung stark vermindert. Erhöhte Konzentrationen in Oberflächengewässern weisen auf industrielle Abwassereinleitung oder Auslaugung von Deponien hin (Indikatorfunktion).
Grenzwert Trinkwasserverordnung: 0,0010 mg/L.
Radon-222
Durch den radioaktiven Zerfall des Spurenelements Radium entsteht das Edelgas Radon-222. Es diffundiert an die Erdoberfläche und verdünnt sich in der Atmosphäre auf eine Konzentration von im Mittel 15 Becquerel pro Kubikmeter Luft (Bq/m3].
Radon zählt zu den natürlichen Strahlenquellen, die seit Milliarden Jahren in der Erdrinde oder Atmosphäre vorkommen. Durch Ausgasungsprozesse aus Gestein und Grundwasser kann Radon-222 in Anlagen zur Wassergewinnung, -aufbereitung und -verteilung aufkonzentrieren, ursächlich bedingt durch die schwache Belüftung in diesen Betriebsräumen.
Desweiteren ist die Radon-222 Konzentration in den Betriebsräumen abhängig von Füllstandsverläufen in Behältern, vom Luftdruck, von Temperaturdifferenzen zur Außenluft, Jahreszeiten und Tageszeiten.
Nach der Strahlenschutzverordnung sind Betriebe mit konkreten Arbeitsfeldern wie oben genannt verpflichtet, die Radon-222 Exposition ihrer Mitarbeiter zu ermitteln. Die jährliche Radon-222 Exposition von 6*106 Bqh/m3 oder effektive Dosis von 20 mSv/a darf nicht überschritten werden. Ab dem Eingreifwert von 2*10 6 Bqh/m3 beziehungsweise einer effektiven Dosis von 6 mSv/a hat eine Anzeige bei der zuständigen Behörde zu erfolgen.
Regenerat
Bei der Regeneration von Filtermaterialien anfallende Stoffströme, in der Regel Abwasser / Abfall.
Regeneration
Unter Regeneration versteht man die Wiederherstellung bestimmter chemischer od. physikalischer Eigenschaften von Filtermaterialien durch thermische oder chemische Behandlung.
Rückspülung
Unter Rückspülung versteht man in der Wasseraufbereitung die Reinigung eines Filters durch Auswaschen in entgegengesetzter Fließrichtung. Die Rückspülgeschwindigkeit beträgt dabei ein vielfaches der Filtrationsgeschwindigkeit. Die im Filterbett abgesetzten Stoffe werden durch die Rückspülung entfernt, das im Filterbett enthaltene Material wird aufgelockert.
Selen
Selen tritt als Halbmetall in mehreren Modifikationen auf. Die beständigste, graue Form kommt sehr selten und nur zusammen mit Schwefel vor. So wird Selen praktisch in allen sulfidischen Erzen in Spuren gefunden. Der Selengehalt im Boden ist starken Schwankungen unterworfen. Selenreich sind bestimmte Gegenden Irlands, selenarme Gebiete sind z.B. Neuseeland.
Die Verwendung von Selen umfaßt bei Verhüttung sulfidischer Erze die Katalysatorfunktion, hilft bei der Farbgebung von Gläsern, Halbleiterherstellung, Vulkanisation, Gleitmittel in Schmierölen. In Selenarmen Gegenden wird es dem Tierfutter zugesetzt. Medizinisch werden selenhaltige Medikamente als Herzmittel eingesetzt. Hier wird seine Funktion als Spurenelement deutlich. In Überdosen entfaltet es toxische Wirkungen. Besonders auf Haut und Schleimhäuten, der Lunge, im Magen-Darm-Trakt und auf Leber und Nieren wirkt es schädigend ein.
Erhöhte Selengehalte deuten auf industrielle Verunreinigungen oder geogene Belastungen hin.
Grenzwert Trinkwasserverordnung: 0,010 mg/L.
Sorbat
Sorbens mitsamt aufgenommenem Sorptiv (Adsorption).
Sorbens
Aufnehmende feste Phase bei der Adsorption.
Strontium
Strontium ist als Spurenelement im Boden und in Pflanzen zu finden, der Anteil an der oberen Erdkruste beträgt etwa 0,03%.
Im menschlichen Körper sind etwa 100 - 200 mg dieses Metalls der Erdalkaligruppe enthalten, die Aufnahme erfolgt mit der Nahrung (u.a. mit Milchprodukten). Als essentielles Spurenelement für den Menschen wirkt Strontium nur bei der Aufnahme von höheren Dosen schädlich.
Die in Gewässern und im Trinkwasser auftretenden Strontium-Konzentrationen sind vergleichsweise sehr gering und überwiegend geologischen Ursprungs.
Sulfat SO42-
Sulfatkonzentrationen im Grundwasser von über 30 mg/L können auf Gipsvorkommen im Untergrund zurückzuführen sein.
Höhere Sulfatkonzentrationen machen sich geschmacklich nachteilig bemerkbar und können die Korrosion fördern. Auch in der Bauwirtschaft ist der Sulfatgehalt des Wassers von Bedeutung. Konzentrationen über 200 mg/L wirken sich negativ auf die Haltbarkeit von Beton aus.
Grenzwert Trinkwasserverordnung: 250 mg/L
Tetrachlorethen und Trichlorethen
Tetrachlorethen und Trichlorethen sind halogenorganische Chlorverbindungen relativ einfacher Struktur, die als Lösemittel, Weichmacher, Holzschutzmittel und Reinigungsmittel Anwendung finden. Unbeabsichtigt können diese Verbindungen bei der Desinfektion von Trinkwasser und Schwimmbadwassser mit Chlor entstehen. Ca. 90 % gehen durch die leichte Flüchtigkeit der Substanzen in die Atmosphäre über. Durch Niederschläge gelangen beide halogenierte Chlorverbindungen wieder in den Wasserkreislauf, besonders von Oberflächenwässern. Beide Substanzen werden als krebserregend eingestuft und wirken auf das zentrale Nervensystem.
Grenzwert Trinkwasserverordnung: 0,010 mg/L als Summe der für beide Substanzen nachgewiesenen Konzentrationen.
TIC
Total inorganic carbon. Gesamter anorganisch gebundener Kohlenstoff.
TOC
Total organic carbon. Gesamter organisch gebundener Kohlenstoff.
Der TOC ist die Summe des organisch gebundenen Kohlenstoffs in gelösten und ungelösten Verbindungen.
Grenzwert Trinkwasserverordnung: ohne anormale Veränderung
Trihalogenmethane
Die Trihalogenmethane (THM) Trichlormethan (Chloroform), Bromdichlormethan, Dibromchlormethan und Tribrommethan (Bromoform) entstehen als Desinfektionsnebenprodukte bei der Chlorung von Trinkwasser. Die Bildung dieser Desinfektionsnebenprodukte kann minimiert werden, indem die Vorläuferverbindungen im Rohwasser, wie z.B. Huminsäuren, in der Aufbereitung auf geeignete Weise entfernt werden.
THM wirken toxisch auf Leber und Nieren und könnten kanzerogen wirken.
Durch guten Trinkwasserresourcenschutz in Verbindung mit hoher Aufbereitungsgüte ist es in Deutschland vielfach möglich, die chemische Desinfektion zu vermeiden. So sind bei ca. 50 % der Versorgungsanlagen Chlorungen nicht notwendig. Bei gechlorten Wässern liegt die mittlere Konzentration an THM in der Größenordnung von 1-4 µg/L am Wasserwerksausgang. Dieser Wert ist 10-20 mal niedriger als Mittelwerte in den USA, und bewegt sich im unteren Drittel der in anderen europäischen Staaten gemessenen Werte. Diese hohe Qualität der Trinkwasserversorgung in Deutschland spiegelt sich wieder im
Summengrenzwert der Trinkwasserverordnung: 0,050 mg/L am Zapfhahn des Verbrauchers.
Eine Untersuchung im Versorgungsnetz ist nicht erforderlich, wenn am Ausgang des Wasserwerks der Wert von 0,010 mg/l nicht überschritten wird.
Trinkwasserverordnung
In der Trinkwasserverordung sind die mikrobiologischen, die chemischen und chemisch-physikalischen Eigenschaften, die Trinkwasser aufweisen muss, festgelegt.
Die EG-Richtlinie 98/83/EG vom 03.11.1998 bildet die gesetzliche Grundlage für die Qualität von Wasser für den menschlichen Gebrauch im Bereich der Europäischen Union (EU). Die Anforderungen der EG-Richtlinie sind von den Mitgliedsstaaten der EU in nationales Recht umzusetzen. Verschärfte Anforderungen können in das nationale Recht eingeführt werden.
In Deutschland dient die Trinkwasserverordnung der Umsetzung der EG-Richtlinie, auf Basis des Infektionsschutzgesetzes.
Durch die "Erste Verordnung zur Änderung der Trinkwasserverordnung" erfolgte eine Aktualisierung der Anforderungen.
Datum des Inkrafttretens: 01.11.2011
Tritium (H-3)
Tritium ist eine natürliche radioaktive Verbindung, die in der Atmosphäre aufgrund von kosmischer Strahlung ständig gebildet wird. Durch die Anlagerung eines weiteren Wasserstoff-Atoms an ein vorhandenes Wasserstoffmolekül entsteht die Verbindung H-3.
Zum Vergleich: derzeitige Aktivitätskonzentrationen von Tritium im Niederschlag befinden sich zwischen <1 und 2 Bq/L (Messungen niedersächsisches Landesamt für Ökologie, Hildesheim).
Grenzwert Trinkwasserverordnung: 100 Bq/L
Trübung
Die Eigenschaft von Wasser, eingestrahltes Licht an feindispersiven, suspendierten Partikeln zu streuen bzw. die Durchsichtigkeit des Wassers zu verringern, wird als Trübung bezeichnet. Trübungen entstehen im Rohwasser durch organische und anorganische Schwebstoffe, sowie durch lebende Organismen. Somit ist die Trübung oft ein Maß bzw. Indikator für Verunreinigungen im Wasser. Die Trübung dient in der Wasseraufbereitung der Überwachung (z.B. bei schwankender Wasserqualität) und der Verfahrensoptimierung (z.B. Flockung, Filtration).
Quantifiziert wird Trübung durch eine Trübungsmessung unter der Verwendung optischer Messgeräte. Die Messwerte werden mit Einheiten angegeben, die sich auf die Kalibrierung mit Formazin-Standard-Suspensionen beziehen. In der Trinkwasserverordnung werden die nephelometrischen Trübungseinheiten (NTU) benutzt.
Grenzwert Trinkwasserverordnung: 1,0 NTU
Der Grenzwert gilt als eingehalten, wenn am Ausgang des Wasserwerks der Grenzwert nicht überschritten wird. Ein plötzlicher oder kontinuierlicher Anstieg (auch im Verteilungsnetz) ist unverzüglich der zuständigen Behörde zu melden.
Uran
Uran ist als geogener Bestandteil vieler Böden und Grundwasserleiter vorhanden, häufig jedoch nur im Spurenbereich geringster Konzentrationen. Nur sehr selten sind Urangehalte in Grund- oder Oberflächenwässern auf anthropogene Einflüsse (Uranbergbau, uranhaltiger Phosphatdünger) zurück zu führen.
Der Nachweis von Uran in einigen Roh- und Trinkwässern sowie die toxikologische Bewertung der lebenslang duldbaren Höchstkonzentration zum Schutz vor chemischer Nierentoxizität führten zur erstmaligen Einführung eines Grenzwertes in der Trinkwasserverordnung, mit Gültigkeit ab dem 01.11.2011. Die Radiotoxizität des Urans ist im durch den Grenzwert vorgegebenen maximalen Konzentrationsbereich nicht relevant.
Grenzwert Trinkwasserverordnung: 0,010 mg/L.
Vinylchlorid
Vinylchlorid ist ein farbloses Gas mit schwach süßlichem Geruch. In fast allen organischen Lösemitteln, bzw. Flüssigkeiten ist es unbegrenzt löslich. Die Synthese erfolgt über Anlagerung von Chlorwasserstoff an Acetylen oder über die Spaltung von 1,2-Dichlorethan in Vinylchlorid und Chlorwasserstoff. In der Industrie wird Vinylchlorid zur Herstellung von PVC verwendet.
Es wirkt auf die menschliche Gesundheit mutagen und canzerogen, wobei diese Wirkungen nicht von der Orginalsubstanz, sondern von im Körper gebildeten Metaboliten ausgehen. Äußere Vergiftungserscheinungen zeigen sich durch Reizung der Augen und Durchblutungsstörungen, daneben besteht eine narkotische Wirkung. Chronische Vergiftungen betreffen die Lunge, Leber, Nieren und das Zentralnervensystem.
Durch Abwässer der Vinylchlorid verarbeitenden Industrie kann es in Oberflächengewässer gelangen. Grundwässer werden nicht durch industrielle Vorgänge, sondern durch den mikrobiellen Abbau ungesättigter halogenierter Lösemittel zu Vinylchlorid mit dieser Substanz kontaminiert. Weiterhin können bei in der Wasserverteilung verwendeten Kunststoffrohren aus PVC geringe Mengen von Restmonomeren in das Trinkwasser gelangen. Durch Belüftung kann Vinylchlorid weitgehend eliminiert werden.
Grenzwert Trinkwasserverordnung: 0,00050 mg/L.
Wasserstoffperoxid
Wasserstoffperoxid (H2O2) ist bei der Trinkwasseraufbereitung ausschließlich zum Verwendungszweck Oxidation zugelassen (siehe Aufbereitungsstoffe).
Ferner wird Wasserstoffperoxid zur Desinfektion von Anlagenteilen der Trinkwasserversorgung (z.B. Rohrleitungen, Behälter, Armarturen) eingesetzt, welche sich (noch) nicht in Betrieb befinden. Vor der Inbetriebnahme sind die Anlagenteile gründlich zu spülen. Das bei der Desinfektion und Spülung verwendete Wasser kann im Gegensatz zur Verwendung von chlorhaltigen Desinfektionsmitteln relativ einfach entsorgt werden.
Links zu interessanten Wasser-Seiten
Wasser-Lexikon vom Zweckverband zur Wasserversorgung Moosrain
© 31. Oktober 2011, WebTeam VFTV e.V.